SEC 2021 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Héctor Bueno
Presidente del Comité Científico del Congreso
Comité ejecutivo
Comité de evaluadores
Listado de sesiones
Índice de autores
5010. Nuevas aplicaciones clínicas en imagen cardiaca avanzada
5010-6. PREDICCIÓN DEL DESARROLLO DE FIBRILACIÓN AURICULAR MEDIANTE STRAIN AURICULAR EN PACIENTES CON MIOCARDIOPATÍA HIPERTRÓFICA
1Hospital Universitario Virgen de Valme, Sevilla. 2Hospital Universitario Virgen del Rocío, Sevilla. 3Hospital de Alta Resolución de Utrera, Sevilla.
Introducción y objetivos: En los pacientes con miocardiopatía hipertrófica (MCH) el desarrollo de fibrilación auricular (FA) supone un impacto pronóstico en su calidad y esperanza de vida, siendo fundamental la detección precoz de la misma. En otras cardiopatías, la presencia de un strain longitudinal de la aurícula izquierda (SLA) disminuido se ha relacionado con una mayor incidencia de FA. Nuestro objetivo es determinar si un SLA alterado predice el desarrollo de FA en nuestra población de MCH.
Métodos: Estudio prospectivo de una cohorte de pacientes con MCH. Analizamos la media del SLA de los pacientes que ya presentaban FA al inicio del seguimiento para determinar el valor que consideramos como SLA alterado. Posteriormente, realizamos un seguimiento de aquellos pacientes que no habían desarrollado FA y valoramos si la un SLA alterado se relacionaba con el desarrollo de FA en el seguimiento.
Resultados: Se incluyeron 146 pacientes, 50% varones, mediana de edad 66 años [50-74]. 57% hipertensos, 26% diabéticos, 50% dislipémicos y 2% enfermedad pulmonar obstructiva crónica. La mediana del riesgo de muerte súbita por HCM risk SCD fue de 1,98% [1,3-2,9]. 42 (29%) presentaban FA al inicio del seguimiento. En la tabla se muestran los parámetros ecocardiográficos analizados en los pacientes con y sin FA al inicio del seguimiento, destacando una diferencia estadísticamente significativa el SLA (13 vs 30%) y en el diámetro de la AI (48 vs 41 mm). Se siguieron a los 104 pacientes sin FA durante 36 ± 5 meses. 11% desarrollaron FA en el seguimiento, mediana de tiempo hasta su aparición 26 meses [8-29]. Se analizaron las características basales de los que desarrollaron FA y los que no, sin diferencias en parámetros como el diámetro y el volumen de la AI. El único parámetro relacionado de forma estadísticamente significativa con el desarrollo de FA fue la presencia de un SLA alterado (< 13%) (fig.). Además, los pacientes que desarrollaron FA presentaron mayor riesgo de hospitalización por insuficiencia cardiaca en el seguimiento (p = 0,025, OR 8).
|
Parámetros ecocardiográficos de los pacientes con y sin FA al inicio del seguimiento |
|||
|
Parámetros ecocardiográficos |
FA (n = 42) |
No FA (n = 104) |
p |
|
Volumen AI (ml) |
77 (66,3 -102,8) |
69 (57,5 -88,5) |
0,260 |
|
Diámetro AI (mm) |
47,5 (43-55,5) |
41 (38-45) |
< 0,001 |
|
Strain longitudinal AI (%) |
12,6 ± 7,3 |
29,5 ± 11,7 |
< 0,001 |
|
Espesor miocárdico (mm) |
20 (18-24,2) |
20 (27-24) |
0,739 |
|
Disfunción diastólica |
19 (45,2) |
37 (35,6) |
0,277 |
|
Diámetro telediastólico del VI (mm) |
44 (38-48) |
43 (39,3 -47) |
0,761 |
|
Los datos se expresan en n (%), en mediana (p25-p75) y en media ± desviación estándar. AI: aurícula izquierda; FA: fibrilación auricular; VI: ventrículo izquierdo. |
|||
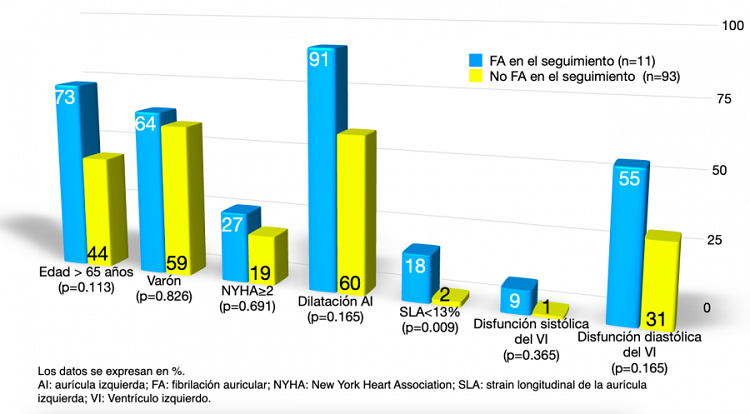
Características diferenciales entre los pacientes que desarrollaron FA y los que no lo hicieron durante el seguimiento.
Conclusiones: En nuestra cohorte de pacientes con MCH, la única variable predictora del desarrollo de FA en el seguimiento fue la presencia de un SLA alterado (< 13%), no así el volumen o el diámetro de la AI, por lo que se debería valorar en el screening de FA para mejorar su detección precoz y prevenir las comorbilidades asociadas a la misma.
Comunicaciones disponibles de "Nuevas aplicaciones clínicas en imagen cardiaca avanzada"
- 5010-1. MODERADOR
- Eduardo Moreno Escobar, Granada
- 5010-2. MEDICIÓN SEMIAUTOMÁTICA DE MAPAS DE DIÁMETRO Y TASA DE CRECIMIENTO AÓRTICO MEDIANTE REGISTRO DE ANGIOGRAFÍAS POR TOMOGRAFÍA COMPUTARIZADA
- Lydia Dux-Santoy Hurtado1, José Fernando Rodríguez Palomares2, Gisela Teixidó Turà2, Aroa Ruiz Muñoz1, Guillem Casas Masnou2, Filipa Valente2, María Luz Servato2, Laura Galian Gay2, Laura Gutiérrez García-Moreno2, M. Teresa González Alujas2, Rubén Fernández Galera2, Arturo Evangelista Masip1, Ignacio Ferreira González2 y Andrea Guala1
1Vall d'Hebron Institut de Recerca, Barcelona. 2Hospital Universitario Vall d'Hebron, Barcelona.
- 5010-3. EFECTO DE SUSTITUIR EL VOLUMEN DE LA AURÍCULA IZQUIERDA POR EL STRAIN LONGITUDINAL AURICULAR IZQUIERDO EN EL ALGORITMO DE LA SOCIEDAD AMERICANA DE ECOCARDIOGRAFÍA/SOCIEDAD EUROPEA DE IMAGEN CARDIACA 2016 PARA EL DIAGNÓSTICO ECOCARDIOGRÁFICO DE FUNCIÓN DIASTÓLICA
- Elene Sáez de Buruaga Corrales, Raquel Soria Navarro, Elena Virosta Gil, María Garrido Uriarte, Olatz Zaldua Irastorza, Ángela Alonso Miñambres, Sara González de Alaiza Ortega, María Jesús Apodaca Arrizabalaga, Lucas Tojal Sierra y Ángel M. Alonso Gómez
Hospital Universitario Araba, Vitoria-Gasteiz, Araba.
- 5010-4. CARACTERIZACIÓN MEDIANTE T-1 MAPPING DE LA FIBROSIS MIOCÁRDICA DIFUSA ASOCIADA A OBESIDAD EN EL PRIMER INFARTO AGUDO DE MIOCARDIO
- Fabián Islas Ramírez1, María Luaces Méndez1, Victoria Cachofeiro Ramos2, Ernesto Martínez Martínez2, Ana Bustos de Castro1, Beatriz Cabeza Martínez1, Irene Martín Lores1, Andrea Martínez Cámara1, Sergio López Tejero1, Juan Arrazola García1 y Carlos Macaya Miguel1
1Hospital Clínico San Carlos, Madrid. 2Universidad Complutense, Madrid.
- 5010-5. IMPLICACIONES DE LA FIBRILACIÓN AURICULAR EN PARÁMETROS DE DEFORMACIÓN MIOCÁRDICA DE PACIENTES CON MIOCARDIOPATÍA DILATADA NO ISQUÉMICA
- Pablo Eduardo Tobías-Castillo, Eduard Ródenas-Alesina, Jordi Lozano-Torres, Rosa Vila-Olives, María Calvo-Barceló, Clara Badia-Molins, María Josefa Azpiroz-Franch, Roxana Andreina Escalona-Silva, Guillem Casas-Masnou, Rubén Fernández-Galera, Ana Belén Méndez-Fernández, Nuria Rivas-Gándara, Ignacio Ferreira-González y José Fernando Rodríguez-Palomares
Servicio de Cardiología, Hospital Universitario Vall d'Hebron, Barcelona.
- 5010-6. PREDICCIÓN DEL DESARROLLO DE FIBRILACIÓN AURICULAR MEDIANTE STRAIN AURICULAR EN PACIENTES CON MIOCARDIOPATÍA HIPERTRÓFICA
- Irene Esteve Ruiz1, Helena Llamas Gómez2, Iris María Esteve Ruiz3, Dolores García Medina1, Ricardo Pavón Jiménez1 y Francisco Javier Molano Casimiro1
1Hospital Universitario Virgen de Valme, Sevilla. 2Hospital Universitario Virgen del Rocío, Sevilla. 3Hospital de Alta Resolución de Utrera, Sevilla.
- 5010-7. UTILIDAD DE LA IMAGEN CARDIACA AVANZADA EN LA PREDICCIÓN DE EVENTOS CARDIOVASCULARES EN PACIENTES CON MIOCARDIOPATÍA DILATADA NO ISQUÉMICA
- Marcos Ferrández Escarabajal, Carmen Olmos Blanco, Alejandro Travieso González, Jesús Diz Díaz, Pablo Zulet Fraile, Carlos Nicolás Pérez García, María Alejandra Restrepo Córdoba, Josebe Goirigolzarri Artaza, María Luaces Méndez, José Alberto de Agustín Loeches, Ana Bustos y Fabián Islas Ramírez
Hospital Clínico San Carlos, Madrid.
- 5010-8. MODELO INTEGRAL PARA PREDECIR FIBRILACIÓN AURICULAR EN PACIENTES CON ICTUS CRIPTOGÉNICO: DECRYPTORING SCORE
- Alberto Vera Sainz, Alberto Cecconi, Álvaro Ximénez Carrillo, Carmen Ramos, Pablo Martínez Vives, Beatriz López Melgar, Antonio Manuel Rojas González, Lourdes Domínguez Arganda, Guillermo Diego Nieto, Amparo Benedicto Buendía, Ancor Sanz García, Pilar Roquero Giménez, María Martínez-Avial Silva, Fernando Alfonso y Luis Jesús Jiménez Borreguero
Hospital Universitario de La Princesa, Madrid.
Más comunicaciones de los autores
- Esteve Ruiz, Irene
- Esteve Ruiz, Iris María
- García Medina, Dolores
- Llamas Gómez, Helena
-
Molano Casimiro, Francisco Javier
- 4021-2 - IMPACTO PRONÓSTICO A LARGO PLAZO DE LA REHABILITACIÓN CARDIACA EN PACIENTES CON DISFUNCIÓN VENTRICULAR IZQUIERDA DE ORIGEN ISQUÉMICO
- 5010-6 - PREDICCIÓN DEL DESARROLLO DE FIBRILACIÓN AURICULAR MEDIANTE STRAIN AURICULAR EN PACIENTES CON MIOCARDIOPATÍA HIPERTRÓFICA
- 6012-2 - IMPLEMENTACIÓN DE ISGLT2 EN LA PRÁCTICA CLÍNICA REAL. PERFIL CLÍNICO E IMPACTO PRONÓSTICO
- 6012-6 - NUEVOS PILARES DE TRATAMIENTO EN LA INSUFICIENCIA CARDIACA. ¿HEMOS MODIFICADO EL TRATAMIENTO Y PRONÓSTICO DE NUESTROS PACIENTES EN LOS ÚLTIMOS AÑOS?
- 6041-13 - 5 AÑOS DE SEGUIMIENTO EN CONSULTA DE INSUFICIENCIA CARDIACA, ¿CONSEGUIMOS MODIFICAR LA HISTORIA NATURAL DE LA ENFERMEDAD?
- Pavón Jiménez, Ricardo
