SEC 2023 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Juan José Gómez Doblas
Presidente del Comité Científico del Congreso
Vicepresidente de la SEC
Comités ejecutivo, organizador y científico
Comité de evaluadores
Listado de sesiones
Índice de autores
6. Novedades en amiloidosis cardiaca
15. EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 2Hospital Universitario de Bellvitge, Hospitalet de Llobregat (Barcelona), España.
Introducción y objetivos: El diflunisal es un antiinflamatorio no esteroideo que se utiliza off-label en el tratamiento de la amiloidosis cardiaca por transtirretina (ATTR-CA) ya que ha demostrado estabilizar la transtirretina in vitro y retrasar la afectación neurológica en la ATTR hereditaria. El objetivo fue evaluar la tolerabilidad, seguridad y eficacia de su uso en ATTR-CA.
Métodos: Estudio retrospectivo longitudinal de pacientes con ATTR-CA a los que se inició diflunisal en un centro español entre junio/2018 y marzo/2023. Se evaluaron características basales, tolerancia al fármaco e incidencia de eventos en el seguimiento.
Resultados: Se administró diflunisal (250 mg/12 h) a 30 pacientes, 93% varones, edad 77,5 ± 10 años, 83,3% en estadio NAC I, 28 ATTRwt y 2 ATTRv (Val50Met y Ala65Thr). La duración mediana del tratamiento fue 260 días (rango 4-1378 días). Se administró un inhibidor de la bomba de protones en el 73% y 36,6% estaban anticoagulados. Un paciente recibía patisirán por afectación neurológica. En 7 pacientes (23,3%) se suspendió el tratamiento por efectos adversos (2 por epigastralgia, 2 empeoramiento de función renal, 2 por sangrado no vital [gingivorragia tras inicio de ACOD y epistaxis] y uno por parestesias) tras un uso medio de 112 días (rango 4-196). Otros 4 lo suspendieron tras un uso medio de 591 días para acceder a ensayos clínicos y 1 por futilidad (483 días de tratamiento). En 5 pacientes (16,6%) se observó un aumento de creatinina (> 0,3 mg/dl) tras inicio de tratamiento, pero no suspendieron el fármaco y las cifras se estabilizaron en el seguimiento. Hubo 4 sangrados relevantes, 3 no vitales (los dos descritos y un hematoma espontáneo del brazo) y un hematoma subdural tras caída. En estos dos últimos no se suspendió diflunisal tras el evento. No se reportaron muertes en el seguimiento. Se analizó la evolución de los biomarcadores (n = 28) tras una mediana de 260 días de tratamiento (rango 4-1213), documentando un leve aumento de creatinina, NTproBNP y hemoglobina (tabla). No se observaron cambios ECG (n = 26, mediana seguimiento 325 días) ni ecocardiográficos (n = 13, mediana seguimiento 439 días).
|
Evolución durante el seguimiento |
|||
|
|
Basal |
Follow-up |
p |
|
Bioquímica (N = 28) |
|||
|
Creatinina (mg/dl) |
0,92 ± 0,16 |
1,07 ± 0,27 |
< 0,001 |
|
NTproBNP (pg/ml) |
925 (281-1.686) |
1.692,5 (580,5-2.438,5) |
0,004 |
|
Troponina I US (ng/L) |
30 (24-39) |
22 (21-80) |
0,31 |
|
Hb (g/dl) |
14,9 ± 1,2 |
15,3 ± 1,4 |
< 0,001 |
|
Plaquetas |
189 × 103 (157-235) |
173 × 103 (136-215) |
0,01 |
|
Ecocardiograma (N = 13) |
|||
|
FEVI |
57,1 ± 10,5 |
53 ± 15,6 |
0,18 |
|
DTDVI |
42,7 ± 1,6 |
43,8 ± 1,9 |
0,48 |
|
VTDVI |
105,6 ± 37,6 |
105,3 ± 34,7 |
0,98 |
|
SIV |
16,4 ± 2,84 |
16,2 ± 2,82 |
0,86 |
|
Masa VI |
265,7 ± 96,6 |
258 ± 84,7 |
0,39 |
|
Diámetro AI |
41 (38-44) |
42,5 (37-46,5) |
0,9 |
|
SLG |
17,8 ± 4,1 |
16,9 ± 4,7 |
0,62 |
|
Electrocardiograma (N = 26) |
|||
|
FA |
6 (23,1%) |
10 (38,4%) |
0,12 |
|
Bajos voltajes |
4 (15,4%) |
3 (11,5%) |
0,56 |
|
Bloqueo de rama |
3 (12,5%) |
6 (26,1%) |
0,21 |
|
PseudoIAM |
10 |
10 |
1 |
|
AI: aurícula izquierda; DTDVI: diámetro telediastólico ventricular izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección ventricular izquierda; masa VI: masa ventricular izquierda; VTDVI: volumen telediastólico ventricular izquierdo; SIV: septo interventricular; SLG: strain longitudinal global. |
|||
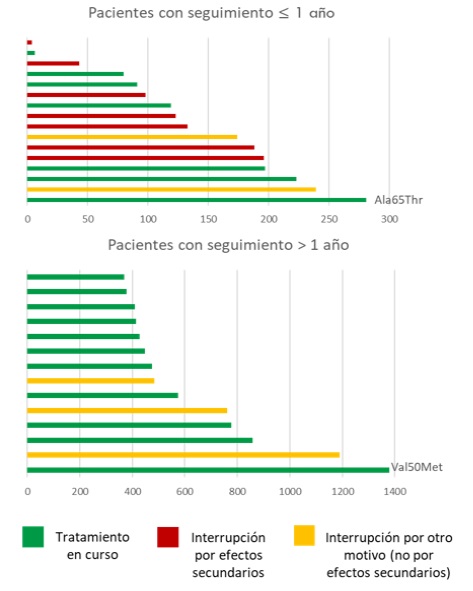
Duración del tratamiento con diflunisal.
Conclusiones: El diflunisal tuvo una tolerancia razonable. Los eventos adversos más frecuentes consistieron en empeoramiento de función renal, epigastralgia y hemorragia menor. Fueron de carácter leve y ocurrieron en los primeros meses de tratamiento. No se observaron cambios en los parámetros ECG y ecocardiográficos.
Comunicaciones disponibles de "Novedades en amiloidosis cardiaca"
- 1. MODERA
- Xavier Arana Achaga, Guipúzcoa
- 2. PREVALENCIA DE AMILOIDOSIS CARDIACA POR TRANSTIRRETINA EN PACIENTES ANCIANOS CON FIBRILACIÓN AURICULAR DE RECIENTE APARICIÓN
- Paloma Remior Pérez1, Miriam Gómez Molina2, María Gallego Delgado3, Daniel García Rodríguez4, Francisco Javier de Haro del Moral5, Laroussi Mohamed Salem6, Fernando Hernández Terciado4, Daniel de Castro Campos4, Eduardo Villacorta Argüelles3, Domingo Andrés Pascual Figal2 y Pablo García Pavía4
1Cardiología. Hospital Universitario Ramón y Cajal, Madrid, España, 2Cardiología. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España, 3Cardiología. Complejo Asistencial Universitario de Salamanca, Salamanca, España, 4Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España, 5Medicina Nuclear. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 6Medicina Nuclear. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España.
- 3. ESTUDIO DE PREVALENCIA DE AMILOIDOSIS CARDIACA EN PACIENTES CON ESTENOSIS DE CANAL LUMBAR E HIPERTROFIA DEL LIGAMENTO AMARILLO
- Martín Negreira Caamaño1, Ana María García Vicente2, Marco Aurelio Ramírez Huaranga2, Miguel Angel Rienda Moreno2, David Castro Corredor2, Angel E Plasencia Ezaine2, Jorge Martínez del Río1, Emilio Blanco López2 y Jesús Piqueras Flores2
1Cardiología. Hospital General Universitario de Ciudad Real, Ciudad Real, España y 2Hospital General Universitario de Ciudad Real, Ciudad Real, España.
- 4. CARACTERIZACIÓN DE LA PERFUSIÓN MIOCÁRDICA MEDIANTE TOMOGRAFÍA COMPUTARIZADA ESPECTRAL EN PACIENTES CON AMILOIDOSIS CARDIACA
- Cristian Herrera Flores, María Gallego Delgado, Sara Rodríguez Diego, Rocío Eiros Bachiller, Antonio Sánchez Puente, Leticia Nieto García, Pablo Pérez Sánchez, Pedro Pablo Vara González, Luis Miguel Rincón Díaz, Pedro Luis Sánchez Fernández y Candelas Pérez del Villar Moro
Servicio de Cardiología, Hospital Universitario de Salamanca. Instituto de Biomedicina de Salamanca IBSAL. Universidad de Salamanca. CIBER-CV. Instituto de Salud Carlos III. Complejo Asistencial Universitario de Salamanca, Salamanca, España.
- 5. VALIDACIÓN DE UNA PUNTUACIÓN CLÍNICA DE RIESGO DE AMILOIDOSIS POR TRANSTIRRETINA EN UNA COHORTE MEDITERRÁNEA DE PACIENTES
- Germán Cediel Calderón1, Javier Santesmases Ejarque2, Mar Domingo Teixidor3, Gloria Moragas Freixa4, Montserrat Solà Suarez4, Xavier García Calvo2, Guillem Guix Camps2, Cristina Pacho Pacho2, Evelyn Santiago Vacas1, Andrea Borrellas Martín1, Pau Codina Verdaguer1, Cinta Llibre Pallarés1, María Ruiz Cueto1, Josep Lupón Rosés1 y Antoni Bayés Genís1
1Cardiología. Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España, 2Medicina Interna. Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España, 3Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España y 4Medicina Nuclear. Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España.
- 6. ANÁLISIS DE LA VARIABILIDAD DE LA FRECUENCIA CARDIACA EN REGISTROS CORTOS DE ECG EN AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- Julia Martínez Solé1, Javier Soriano Zorio2, Nerea Mora Ayestarán3, Fiama Caimi4, Rafael Sanchez5, María Calvo Asensio6, Aitana Braza Boïls7, Luis Martínez Dolz6, Esther González López3, Tomás Ripoll Vera4, Javier Soriano8 y Esther Zorio Grima9
1Servicio de Cardiología, CAFAMUSME, Grupo acreditado de Cardiopatías Familiares, Muerte Súbita y Mecanismos de Enfermedad. Hospital Universitari i Politècnic La Fe, Valencia, España, 2Blautic. Universitat Politècnica de Valencia, Valencia, España, 3Servicio de Cardiología, Unidad de Cardiopatías Familiares. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España, 4Servicio de Cardiología, Unidad de Cardiopatías Familiares. Hospital Son Llàtzer, Palma de Mallorca (Illes Balears), España, 5CAFAMUSME, Grupo acreditado de Cardiopatías Familiares, Muerte Súbita y Mecanismos de Enfermedad. Instituto de Investigación Sanitaria La Fe IIS La Fe, Valencia, España, 6Servicio de Cardiología. Hospital Universitari i Politècnic La Fe, Valencia, España, 7CAFAMUSME, Grupo acreditado de Cardiopatías Familiares, Muerte Súbita y Mecanismos de Enfermedad. Instituto de Investigación Sanitaria La Fe IIS La Fe y CIBERCV, Valencia, España, 8Blautic. Universitat Politècnica de València, Valencia, España y 9Servicio de Cardiología, CAFAMUSME, Grupo acreditado de Cardiopatías Familiares, Muerte Súbita y Mecanismos de Enfermedad. Hospital Universitari i Politècnic La Fe. CIBERCV, Valencia, España.
- 7. ELEVACIÓN DE CADENAS LIGERAS Y COMPONENTE MONOCLONAL EN PACIENTES CON AMILOIDOSIS CARDIACA POR TRANSTIRRETINA WILD-TYPE
- José Miguel Vegas Valle1, Esther González García2, Francisco Domínguez Iglesias3, Eva Fonseca Aizpuru4, Aleida Martínez Zapico4, David Carballo Beltran5, Juan Rondán Murillo1, Íñigo Lozano Martínez-Luengas1 y Paula Chávez Collazos5
1Cardiología. Hospital Universitario de Cabueñes, Gijón (Asturias), España, 2Hospital Universitario de Cabueñes, Gijón (Asturias), España, 3Anatomía Patológica. Hospital Universitario de Cabueñes, Gijón (Asturias), España, 4Medicina Interna. Hospital Universitario de Cabueñes, Gijón (Asturias), España y 5Hematología. Hospital Universitario de Cabueñes, Gijón (Asturias), España.
- 8. ANÁLISIS Y COMPARACIÓN DE RED FLAGS Y RETRASOS DIAGNÓSTICOS ENTRE ATTR Y AL EN UNA COHORTE DE PACIENTES CON AMILOIDOSIS CARDIACA
- Emilio Blanco López1, Jesús Piqueras Flores2, Jorge Martínez del Río1, Martín Negreira Caamaño1, Manuel Muñoz García1, Cristina Mateo Gómez1, Daniel Águila Gordo1, Andrez Felipe Cubides Novoa1, María Maeve Soto Pérez1, Pablo Soto Martín1, Beatriz Jiménez Rubio1, Marta Andrés Sierra1 e Ignacio Sánchez Pérez1
1Cardiología. Hospital General Universitario de Ciudad Real, Ciudad Real, España y 2Unidad de Cardiopatías Familiares. Hospital General Universitario de Ciudad Real, Ciudad Real, España.
- 9. EVOLUCIÓN NATURAL DE LA AMILOIDOSIS CARDIACA: DESDE LA APARICIÓN DE RED FLAGS HASTA LA APARICIÓN DE EVENTOS, PASANDO POR EL DIAGNÓSTICO; RESULTADOS EN UNA COHORTE
- Emilio Blanco López1, Jesús Piqueras Flores2, Jorge Martínez del Río1, Martín Negreira Caamaño1, Manuel Muñoz García1, Cristina Mateo Gómez1, Daniel Águila Gordo1, María Maeve Soto Pérez1, Andrez Felipe Cubides Novoa1, Pablo Soto Martín1, Beatriz Jiménez Rubio1, Marta Andrés Sierra1 e Ignacio Sánchez Pérez1
1Cardiología. Hospital General Universitario de Ciudad Real, Ciudad Real, España y 2Unidad de Cardiopatías Familiares. Hospital General Universitario de Ciudad Real, Ciudad Real, España.
- 10. AMILOIDOSIS CARDIACA POR TRANSTIRRETINA, SUS BANDERAS ROJAS Y SU CONTRIBUCIÓN DIAGNÓSTICA
- Helena Alarcos Blasco1, Mikel Arrizabalaga Gil1, Nuria Gutiérrez Ruiz1, Mercedes de la Fuente Vázquez2, Adrián Margarida de Castro1, Raquel Pérez Barquín1, Jon Zubiaur Zamacola1, Carlos Coroas Pascual1, Lucía Muñoz Prejigueiro1, Lucía Abia Sarria1, Adrián Rivas Pérez1, Gonzalo Martín Gorria1 y Luis Ruiz Guerrero1
1Cardiología. Hospital Universitario Marqués de Valdecilla, Santander (Cantabria), España y 2Medicina Interna. Hospital Universitario Marqués de Valdecilla, Santander (Cantabria), España.
- 11. LA AMILOIDOSIS POR TRANSTIRRETINA EN OCTOGENARIOS, ¿SIEMPRE WILD-TYPE?
- Astrid Casadevall Portas1, Coloma Tirón de Llano1, Arola Armengou Arxé2, Ignasi Bellavista Crespo1, Blanca Herrera Martinez1, Pablo de Loma-Osorio1, Lluisa García Garrido1, Antoni Castro Guardiola2 y Ramón Brugada Terradellas1
1Cardiología. Hospital Universitario Dr. Josep Trueta, Girona, España y 2Medicina Interna. Hospital Universitario Dr. Josep Trueta, Girona, España.
- 12. INHIBIDORES DEL COTRANSPORTADOR DE SODIO-GLUCOSA TIPO 2: UNA NUEVA ARMA PARA EL TRATAMIENTO DE LOS PACIENTES CON AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- Joaquín Vila García, Alejandro Lara García, Ángel Manuel Iniesta Manjavacas, Lucía Canales Muñoz, Ricardo Martínez González, Jesús Saldaña García, Ana Torremocha López, Adrián Martínez Roca, Guillermo Pablo de la Osa Hernández, Carlos Rodríguez Carneiro, Isabel Antorrena Miranda, Laura Peña Conde, Elsa Prieto Moriche, Juan Ramón Rey Blas y José Raúl Moreno Gómez
Servicio de Cardiología. Hospital Universitario La Paz, Madrid, España.
- 13. EXPERIENCIA CON INHIBIDORES DEL SGLT2 EN PACIENTES CON AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- Eva Gutiérrez Ortiz1, Rui M. Domingues2, Julia Playán Escribano1, Iria Andrea González García6, Pablo Zulet Fraile1, Inés Ramos González-Cristobal1, Rocío Párraga Gutiérrez1, María José López Yague1, María Victoria Laguna Calle1, Marta Vigara García3, Manuel Méndez Bailón4, Isidre Vila Costa5, Julián Pérez-Villacastín Domínguez5, Josebe Goirigolzarri Artaza5 y María Alejandra Restrepo Córdoba5
1Hospital Clínico San Carlos, Madrid, España, 2Medicina Interna. Hospital de Braga, Braga, Portugal, 3Geriatría. Hospital Clínico San Carlos, Madrid, España, 4Medicina Interna. Hospital Clínico San Carlos, Madrid, España, 5Cardiología. Hospital Clínico San Carlos, Madrid, España y 6Cardiología. Hospital Universitario de Fuenlabrada, Fuenlabrada (Madrid), España.
- 14. PRONÓSTICO DE LOS PACIENTES CON AMILOIDOSIS CARDIACA TRAS IMPLANTE DE TAVI
- Carlos Arellano Serrano, Juan Francisco Oteo Domínguez, Paula Vela Martín, Arturo García Touchard, María del Trigo Espinosa, José Antonio Fernández Díaz, Marta Cobo Marcos, Susana Mingo Santos, Vanessa Moñivas Palomero, Eusebio García-Izquierdo Jaén, Francisco Javier Goicolea Ruigómez, Pablo García Pavia y Javier Segovia Cubero
Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España.
- 15. EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- Belén Peiró Aventín1, Nerea Mora Ayestarán1, Eva Cabrera Romero1, Fernando de Frutos Seminario2, Ana Briceño Hinojo1, Esther González López1, Fernando Domínguez Rodríguez1, Marta Cobo Marcos1, Juan Carlos López-Azor García1, Manuel Gómez Bueno1, Javier Segovia1 y Pablo García-Pavía1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 2Hospital Universitario de Bellvitge, Hospitalet de Llobregat (Barcelona), España.
- 16. EFICACIA Y SEGURIDAD DE LOS SILENCIADORES GÉNICOS EN EL TRATAMIENTO DE LA AMILOIDOSIS HEREDITARIA POR TRANSTIRRETINA
- Tomás Ripoll Vera1, Blanca Serra Cobo2, Eugenia Cisneros Barroso3, Adrián Rodríguez Rodríguez3, Juan González Moreno3, Inés Losada López3, Guadalupe Federik1, Carlos Miguel Veras Burgos1 y Jorge Álvarez Rubio1
1Cardiología. Hospital Universitario Son Llàtzer, Palma de Mallorca (Illes Balears), España, 2Medicina. Universidad de las Islas Baleares, Palma de Mallorca (Illes Balears), España y 3Medicina Interna. Hospital Universitario Son Llàtzer, Palma de Mallorca (Illes Balears), España.
- 17. RESULTADOS PRELIMINARES DEL REGISTRO ESPAÑOL DE AMILOIDOSIS HEREDITARIA POR TRANSTIRRETINA
- Guadalupe Noel Federik1, Carlos Miguel Veras Burgos2, Cristina Pericet3, José González Costello4, Ana José Manovel Sánchez5, Esther Zorio Grima6, Jaume Pons Linares7, José Manuel García Pinilla8, Lucas Tojal Sierra9, Javier Limeres Freire10, Juan Ramón Gimeno Blanes11, Ana García Álvarez12, Rosa Macías Ruíz13, Mª Ángeles Espinosa Castro14 y Tomás Ripoll Vera2
1Hospital Universitario Son Llàtzer, Palma de Mallorca (Illes Balears), España, 2Cardiología. Hospital Universitario Son Llàtzer, Palma de Mallorca (Illes Balears), España, 3Cardiología. Hospital Universitario Puerta de Hierro Majadahonda (Madrid), Madrid, España, 4Cardiología. Hospital Universitario de Bellvitge, Barcelona, España, 5Cardiología. Hospital Juan Ramón Jiménez, Huelva, España, 6Cardiología. Hospital Universitari i Politècnic La Fe, Valencia, España, 7Cardiología. Hospital Son Espases, Palma de Mallorca (Illes Balears), España, 8Cardiología. Hospital Clínico Universitario Virgen de la Victoria, Málaga, España, 9Cardiología. Hospital Universitario Araba-Txagorritxu, Vitoria-Gasteiz (álava), España, 10Cardiología. Hospital Universitario Vall d’Hebron, Barcelona, España, 11Cardiología. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España, 12Cardiología. Hospital Clínic, Barcelona, España, 13Cardiollogía. Hospital Universitario Virgen de las Nieves, Granada, España y 14Cardiología. Hospital General Universitario Gregorio Marañón, Madrid, España.
Más comunicaciones de los autores
- Briceño Hinojo, Ana
-
Cabrera Romero, Eva
- 12 - RESULTADOS DE UN PROGRAMA DE CRIBADO GENÉTICO POBLACIONAL DE AMILOIDOSIS POR TRANSTIRRETINA HEREDITARIA P.GLU109LYS EN UNA ZONA ENDÉMICA
- 6 - EL PEZ CEBRA MUTANTE DSPB-/- COMO MODELO PARA LA MIOCARDIOPATÍA ARRITMOGÉNICA: EL IMPACTO DE LA ACTIVIDAD FÍSICA
- 5 - EL PEZ CEBRA MUTANTE DSPB-/- TERT+/- COMO MODELO DE MIOCARDIOPATÍA ARRITMOGÉNICA: EL IMPACTO DEL ENVEJECIMIENTO EN EL DESARROLLO DE LA ENFERMEDAD
- 5 - PENETRANCIA DE LA MIOCARDIOPATÍA DILATADA EN PORTADORES GENÉTICOS
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
-
Cobo Marcos, Marta
- 14 - PRONÓSTICO DE LOS PACIENTES CON AMILOIDOSIS CARDIACA TRAS IMPLANTE DE TAVI
- 5 - CONTROL DE LOS FACTORES DE RIESGO CARDIOVASCULAR EN UN ESTUDIO MULTICÉNTRICO DE PACIENTES CON INSUFICIENCIA CARDIACA: A CALL TO ACTION
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 5 - ASOCIACIÓN ENTRE EL FLUJO VENOSO INTRARRENAL Y LA TRAYECTORIA DE LA CREATININA EN INSUFICIENCIA CARDIACA AGUDA Y SU INTERACCIÓN CON PARÁMETROS DE DESCONGESTIÓN
- 5 - VARIACIONES DEL FLUJO VENOSO INTRARRENAL EN INSUFICIENCIA CARDIACA AGUDA Y SU VALOR PRONÓSTICO
- 2 - IMPACTO A CORTO PLAZO DE LA IMPLEMENTACIÓN DE LA TERAPIA FUNDACIONAL EN PACIENTES CON NUEVO DIAGNÓSTICO DE INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDA Y BLOQUEO DE RAMA IZQUIERDA
- 3 - IMPACTO DE LOS SÍNDROMES GERIÁTRICOS EN EL PRONÓSTICO LARGO PLAZO DE LOS PACIENTES MAYORES CON INSUFICIENCIA CARDIACA
- 5 - EVOLUCIÓN DE LOS PARÁMETROS ECOCARDIOGRÁFICOS Y DE CONGESTIÓN TRAS EL TRATAMIENTO PERCUTÁNEO DE LA REGURGITACIÓN TRICUSPÍDEA UTILIZANDO UN DISPOSITIVO DE ABORDAJE BORDE A BORDE
- 3 - EVOLUCIÓN NO INVASIVA DEL ACOPLAMIENTO VENTRICULOARTERIAL DEL VENTRÍCULO DERECHO TRAS LA REPARACIÓN TRANSCATÉTER DE LA INSUFICIENCIA TRICUSPÍDEA
- 5 - INHIBIDORES DE COTRANSPORTADOR SODIO-GLUCOSA 2 EN INSUFICIENCIA CARDIACA. CARACTERÍSTICAS Y EVENTOS EN UNA COHORTE NO SELECCIONADA EN VIDA REAL. RESULTADOS DEL REGISTRO CÁSTOR-HF
- 7 - INHIBIDORES DE COTRANSPORTADOR SODIO-GLUCOSA 2 EN INSUFICIENCIA CARDIACA. EVOLUCIÓN DE PARÁMETROS CLÍNICO-ANALÍTICOS A 6 MESES EN UNA COHORTE NO SELECCIONADA. RESULTADOS DEL REGISTRO CÁSTOR-HF
- 15 - MORTALIDAD TRAS IMPLANTE TRANSCATÉTER DE PRÓTESIS VALVULAR AÓRTICA EN PACIENTES CON HIPERTENSIÓN PULMONAR MUY GRAVE
- 5 - CONTROL DE FACTORES DE RIESGO EN PACIENTES CON ENFERMEDAD RENAL AVANZADA Y SÍNDROME CARDIORRENAL. DATOS DEL REGISTRO CARDIOREN
- 9 - PARTICULARIDADES DE LA TERAPIA FUNDACIONAL EN PACIENTES CON NUEVO DIAGNÓSTICO DE INSUFICIENCIA CARDIACA Y FEVI REDUCIDA SECUNDARIA A TAQUICARDIOMIOPATÍA
- 8 - EVALUACIÓN PRECOZ DE LA RESISTENCIA DIURÉTICA: FACTORES PREDICTORES E IMPACTO EN LA EVOLUCIÓN DE PACIENTES CON INSUFICIENCIA CARDIACA AGUDA
- 3 - MANTENIMIENTO DE LA TERAPIA FUNDACIONAL A LOS 6 MESES DEL DIAGNÓSTICO DE LA INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDA
-
de Frutos Seminario, Fernando
- 7 - CALCULADORAS DE RIESGO EN PACIENTES CON INSUFICIENCIA CARDIACA AVANZADA EN TRATAMIENTO CON LEVOSIMENDÁN COMO TERAPIA DESTINO
- 12 - RESULTADOS DE UN PROGRAMA DE CRIBADO GENÉTICO POBLACIONAL DE AMILOIDOSIS POR TRANSTIRRETINA HEREDITARIA P.GLU109LYS EN UNA ZONA ENDÉMICA
- 12 - HISTORIA NATURAL DE LA MIOCARDIOPATÍA DILATADA PEDIÁTRICA POR VARIANTES EN MYH7
- 15 - VALIDACIÓN CLÍNICA DE UN SISTEMA EXPERTO DE AYUDA A LA DECISIÓN CLÍNICA EN EL TRATAMIENTO DE PACIENTES CON MIOCARDIOPATÍA HIPERTRÓFICA
- 10 - EVALUACIÓN SISTEMÁTICA PROSPECTIVA DE PACIENTES JÓVENES CON IMPLANTACIÓN DE MARCAPASOS IDIOPÁTICA
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
-
Domínguez Rodríguez, Fernando
- 13 - FACTIBILIDAD Y SEGURIDAD DE LA ESTIMULACIÓN EN EL ÁREA DE LA RAMA IZQUIERDA EN PACIENTES CON AMILOIDOSIS CARDIACA. EXPERIENCIA EN UN ÚNICO CENTRO
- 8 - REGISTRO NACIONAL DE MIOCARDITIS MY-SEC: EXPERIENCIA INICIAL
- 7 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. ¿VENTRÍCULO DERECHO O IZQUIERDO? COMPARACIÓN DE RENTABILIDAD DIAGNÓSTICA Y COMPLICACIONES
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 15 - MORTALIDAD TRAS IMPLANTE TRANSCATÉTER DE PRÓTESIS VALVULAR AÓRTICA EN PACIENTES CON HIPERTENSIÓN PULMONAR MUY GRAVE
- 16 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. PRONÓSTICO VITAL SEGÚN EL DIAGNÓSTICO ANATOMOPATOLÓGICO
- 2 - ESTUDIO VACCINE-CARDITIS: REGISTRO MULTICÉNTRICO ESPAÑOL DE ENFERMEDAD INFLAMATORIA CARDIACA TRAS VACUNACIÓN CONTRA COVID-19. SUBANÁLISIS DE LOS PACIENTES CON DISFUNCIÓN VENTRICULAR EN FASE AGUDA Y SEGUIMIENTO A 6 MESES
- 8 - EVALUACIÓN PRECOZ DE LA RESISTENCIA DIURÉTICA: FACTORES PREDICTORES E IMPACTO EN LA EVOLUCIÓN DE PACIENTES CON INSUFICIENCIA CARDIACA AGUDA
- 12 - RESULTADOS DE UN PROGRAMA DE CRIBADO GENÉTICO POBLACIONAL DE AMILOIDOSIS POR TRANSTIRRETINA HEREDITARIA P.GLU109LYS EN UNA ZONA ENDÉMICA
-
García Pavía, Pablo
- 7 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. ¿VENTRÍCULO DERECHO O IZQUIERDO? COMPARACIÓN DE RENTABILIDAD DIAGNÓSTICA Y COMPLICACIONES
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 5 - IMPACTO DEL GENOTIPO EN LA RESPUESTA A TRATAMIENTO MÉDICO A LARGO PLAZO EN MIOCARDIOPATÍA DILATADA NO ISQUÉMICA
- 5 - PENETRANCIA DE LA MIOCARDIOPATÍA DILATADA EN PORTADORES GENÉTICOS
- 10 - EVALUACIÓN SISTEMÁTICA PROSPECTIVA DE PACIENTES JÓVENES CON IMPLANTACIÓN DE MARCAPASOS IDIOPÁTICA
- 6 - ENSAYO CLÍNICO ALEATORIZADO DE INTERVENCIÓN CON NTPROBNP EN LA TRANSICIÓN DE PACIENTES HOSPITALIZADOS POR INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN CONSERVADA: ESTUDIO NICE
- 16 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. PRONÓSTICO VITAL SEGÚN EL DIAGNÓSTICO ANATOMOPATOLÓGICO
- 13 - FACTIBILIDAD Y SEGURIDAD DE LA ESTIMULACIÓN EN EL ÁREA DE LA RAMA IZQUIERDA EN PACIENTES CON AMILOIDOSIS CARDIACA. EXPERIENCIA EN UN ÚNICO CENTRO
- 8 - EVALUACIÓN PRECOZ DE LA RESISTENCIA DIURÉTICA: FACTORES PREDICTORES E IMPACTO EN LA EVOLUCIÓN DE PACIENTES CON INSUFICIENCIA CARDIACA AGUDA
- 12 - RESULTADOS DE UN PROGRAMA DE CRIBADO GENÉTICO POBLACIONAL DE AMILOIDOSIS POR TRANSTIRRETINA HEREDITARIA P.GLU109LYS EN UNA ZONA ENDÉMICA
- 12 - HISTORIA NATURAL DE LA MIOCARDIOPATÍA DILATADA PEDIÁTRICA POR VARIANTES EN MYH7
- 2 - PREVALENCIA DE AMILOIDOSIS CARDIACA POR TRANSTIRRETINA EN PACIENTES ANCIANOS CON FIBRILACIÓN AURICULAR DE RECIENTE APARICIÓN
-
Gómez Bueno, Manuel
- 17 - ANÁLISIS DE LA INCIDENCIA Y RESPUESTA CLÍNICA A TERAPIAS PERCUTÁNEAS NO CORONARIAS EN RECEPTORES DE TRASPLANTE CARDIACO O PORTADORES DE ASISTENCIA VENTRICULAR DE LARGA DURACIÓN
- 12 - CARACTERÍSTICAS CLÍNICAS, MANEJO Y PRONÓSTICO DE LOS PACIENTES CON SHOCK CARDIOGÉNICO DE ETIOLOGÍA NO ISQUÉMICA
- 7 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. ¿VENTRÍCULO DERECHO O IZQUIERDO? COMPARACIÓN DE RENTABILIDAD DIAGNÓSTICA Y COMPLICACIONES
- 2 - PRONÓSTICO A LARGO PLAZO DE PACIENTES QUE SOBREVIVEN AL SHOCK CARDIOGÉNICO
- 2 - FALLO PRIMARIO DEL INJERTO TRAS EL TRASPLANTE CARDIACO: EXPERIENCIA EN UNA COHORTE CONTEMPORÁNEA
- 9 - RESULTADOS EN TRASPLANTE CARDIACO EN MIOCARDIOPATÍA HIPERTRÓFICA Y RESTRICTIVA: TENDENCIAS TEMPORALES
- 7 - REVERSIBILIDAD DEL DETERIORO COGNITIVO EN PACIENTES CON INSUFICIENCIA CARDIACA AVANZADA TRAS EL TRASPLANTE CARDIACO
- 6 - FUNCIÓN RENAL TRAS 1 AÑO DEL TRASPLANTE CARDIACO COMO PREDICTOR DE LA EVOLUCIÓN A LARGO PLAZO. PAPEL DE LA GENÉTICA
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 16 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. PRONÓSTICO VITAL SEGÚN EL DIAGNÓSTICO ANATOMOPATOLÓGICO
- 7 - UTILIDAD DEL CARDIOMEMS EN PACIENTES EN LISTA DE ESPERA DE TRASPLANTE CARDIACO
- 16 - UTILIDAD DE LOS PARÁMETROS ECOCARDIOGRÁFICOS COMO PREDICTORES DE MUERTE, TRASPLANTE CARDIACO O ASISTENCIA VENTRICULAR IZQUIERDA TRAS IMPLANTE DE MITRACLIP COMO ESTRATEGIA PUENTE
- 7 - SEGURIDAD CARDIOVASCULAR EN PACIENTES CON LEUCEMIA LINFÁTICA CRÓNICA TRATADOS CON INHIBIDORES DE LA TIROSINA-CINASA DE BRUTON
- 3 - DIFERENCIAS CLÍNICAS E IMPACTO PRONÓSTICO DEL NIVEL ASISTENCIAL DEL HOSPITAL DE PROCEDENCIA EN PACIENTES TRASLADADOS A UN CENTRO DE SHOCK CARDIOGÉNICO
- 16 - INFLUENCIA DE LA DEPRESIÓN Y DEL DETERIORO COGNITIVO EN EL PRONÓSTICO DE LOS PACIENTES INCLUIDOS EN LISTA DE TRASPLANTE CARDIACO
- 7 - EXPERIENCIA INICIAL EN ESPAÑA DE LA TERAPIA DE ACTIVACIÓN BARORREFLEJA EN PACIENTES CON INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDA
- 16 - RESULTADOS DEL EMPLEO DE ASISTENCIAS VENTRICULARES TEMPORALES PARA PACIENTES EN SHOCK CARDIOGÉNICO EN FUNCIÓN DEL DISPOSITIVO Y DEL MOMENTO EVOLUTIVO DEL IMPLANTE
- 8 - ENFERMEDAD RENAL CRÓNICA TRAS EL TRASPLANTE CARDIACO. EVOLUCIÓN A LARGO PLAZO
- 11 - FRAGILIDAD Y DETERIORO PSICOCOGNITIVO EN PACIENTES CON CARDIOPATÍA CONGÉNITA EN LISTA DE ESPERA PARA TRASPLANTE CARDIACO
-
González López, Esther
- 12 - RESULTADOS DE UN PROGRAMA DE CRIBADO GENÉTICO POBLACIONAL DE AMILOIDOSIS POR TRANSTIRRETINA HEREDITARIA P.GLU109LYS EN UNA ZONA ENDÉMICA
- 13 - FACTIBILIDAD Y SEGURIDAD DE LA ESTIMULACIÓN EN EL ÁREA DE LA RAMA IZQUIERDA EN PACIENTES CON AMILOIDOSIS CARDIACA. EXPERIENCIA EN UN ÚNICO CENTRO
- 6 - ANÁLISIS DE LA VARIABILIDAD DE LA FRECUENCIA CARDIACA EN REGISTROS CORTOS DE ECG EN AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
-
López-Azor García, Juan Carlos
- 16 - INFLUENCIA DE LA DEPRESIÓN Y DEL DETERIORO COGNITIVO EN EL PRONÓSTICO DE LOS PACIENTES INCLUIDOS EN LISTA DE TRASPLANTE CARDIACO
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 8 - EVALUACIÓN PRECOZ DE LA RESISTENCIA DIURÉTICA: FACTORES PREDICTORES E IMPACTO EN LA EVOLUCIÓN DE PACIENTES CON INSUFICIENCIA CARDIACA AGUDA
- 2 - IMPACTO CARDIOVASCULAR DE LOS ANTICUERPOS ANTI-HLA DONANTE ESPECÍFICO: ¿ESTAMOS ACTUANDO DEMASIADO TARDE?
- 11 - FRAGILIDAD Y DETERIORO PSICOCOGNITIVO EN PACIENTES CON CARDIOPATÍA CONGÉNITA EN LISTA DE ESPERA PARA TRASPLANTE CARDIACO
- 7 - REVERSIBILIDAD DEL DETERIORO COGNITIVO EN PACIENTES CON INSUFICIENCIA CARDIACA AVANZADA TRAS EL TRASPLANTE CARDIACO
-
Mora Ayestarán, Nerea
- 2 - CARACTERÍSTICAS DE LOS PACIENTES REMITIDOS A IMPLANTE DE TERAPIA DE RESINCRONIZACIÓN CARDIACA SEGÚN LA EDAD
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 6 - ANÁLISIS DE LA VARIABILIDAD DE LA FRECUENCIA CARDIACA EN REGISTROS CORTOS DE ECG EN AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 15 - VALIDACIÓN CLÍNICA DE UN SISTEMA EXPERTO DE AYUDA A LA DECISIÓN CLÍNICA EN EL TRATAMIENTO DE PACIENTES CON MIOCARDIOPATÍA HIPERTRÓFICA
- 5 - IMPACTO DEL GENOTIPO EN LA RESPUESTA A TRATAMIENTO MÉDICO A LARGO PLAZO EN MIOCARDIOPATÍA DILATADA NO ISQUÉMICA
- 4 - IMPACTO PRONÓSTICO DE LA RESPUESTA A LA TERAPIA DE RESINCRONIZACIÓN EN UNA COHORTE DE PACIENTES CON MIOCARDIOPATÍA DILATADA
- Peiró Aventín, Belén
-
Segovia Cubero, Javier
- 5 - CONTROL DE LOS FACTORES DE RIESGO CARDIOVASCULAR EN UN ESTUDIO MULTICÉNTRICO DE PACIENTES CON INSUFICIENCIA CARDIACA: A CALL TO ACTION
- 16 - INFLUENCIA DE LA DEPRESIÓN Y DEL DETERIORO COGNITIVO EN EL PRONÓSTICO DE LOS PACIENTES INCLUIDOS EN LISTA DE TRASPLANTE CARDIACO
- 3 - DIFERENCIAS CLÍNICAS E IMPACTO PRONÓSTICO DEL NIVEL ASISTENCIAL DEL HOSPITAL DE PROCEDENCIA EN PACIENTES TRASLADADOS A UN CENTRO DE SHOCK CARDIOGÉNICO
- 7 - SEGURIDAD CARDIOVASCULAR EN PACIENTES CON LEUCEMIA LINFÁTICA CRÓNICA TRATADOS CON INHIBIDORES DE LA TIROSINA-CINASA DE BRUTON
- 6 - LOS EPISODIOS DE HIPERPOTASEMIA EN INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDA SE ASOCIAN CON MAYOR MORTALIDAD, QUE SE DEBE EN PARTE A RETIRADA DE ANTAGONISTAS RECEPTOR MINERALOCORTICOIDE. ESTUDIO SPANIK-HF
- 8 - DIFERENCIAS CLÍNICAS ENTRE LA FORMA ASOCIADA AL SÍNDROME DE ACEITE TÓXICO Y LA HIPERTENSIÓN ARTERIAL PULMONAR IDIOPÁTICA EN EL REGISTRO ESPAÑOL DE HIPERTENSIÓN PULMONAR
- 7 - UTILIDAD DEL CARDIOMEMS EN PACIENTES EN LISTA DE ESPERA DE TRASPLANTE CARDIACO
- 5 - CONTROL DE FACTORES DE RIESGO EN PACIENTES CON ENFERMEDAD RENAL AVANZADA Y SÍNDROME CARDIORRENAL. DATOS DEL REGISTRO CARDIOREN
- 16 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. PRONÓSTICO VITAL SEGÚN EL DIAGNÓSTICO ANATOMOPATOLÓGICO
- 15 - MORTALIDAD TRAS IMPLANTE TRANSCATÉTER DE PRÓTESIS VALVULAR AÓRTICA EN PACIENTES CON HIPERTENSIÓN PULMONAR MUY GRAVE
- 14 - PRONÓSTICO DE LOS PACIENTES CON AMILOIDOSIS CARDIACA TRAS IMPLANTE DE TAVI
- 15 - EFICACIA Y SEGURIDAD DE DIFLUNISAL EN EL TRATAMIENTO DE LA AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 6 - FUNCIÓN RENAL TRAS 1 AÑO DEL TRASPLANTE CARDIACO COMO PREDICTOR DE LA EVOLUCIÓN A LARGO PLAZO. PAPEL DE LA GENÉTICA
- 7 - REVERSIBILIDAD DEL DETERIORO COGNITIVO EN PACIENTES CON INSUFICIENCIA CARDIACA AVANZADA TRAS EL TRASPLANTE CARDIACO
- 2 - FALLO PRIMARIO DEL INJERTO TRAS EL TRASPLANTE CARDIACO: EXPERIENCIA EN UNA COHORTE CONTEMPORÁNEA
- 2 - PRONÓSTICO A LARGO PLAZO DE PACIENTES QUE SOBREVIVEN AL SHOCK CARDIOGÉNICO
- 3 - EFICACIA Y SEGURIDAD DEL DISPOSITIVO REDS PARA UN ALTA SEGURA EN PACIENTES INGRESADOS POR INSUFICIENCIA CARDIACA DESCOMPENSADA: UN ENSAYO CLÍNICO ALEATORIZADO Y CONTROLADO
- 2 - ESTIMULACIÓN EN RAMA IZQUIERDA TRAS IMPLANTE DE PRÓTESIS VALVULAR AÓRTICA TRANSCATÉTER: SEGUIMIENTO A UN AÑO
- 12 - CARACTERÍSTICAS CLÍNICAS, MANEJO Y PRONÓSTICO DE LOS PACIENTES CON SHOCK CARDIOGÉNICO DE ETIOLOGÍA NO ISQUÉMICA
- 7 - BIOPSIA ENDOMIOCÁRDICA DE CORAZÓN NATIVO. ¿VENTRÍCULO DERECHO O IZQUIERDO? COMPARACIÓN DE RENTABILIDAD DIAGNÓSTICA Y COMPLICACIONES
- 11 - FRAGILIDAD Y DETERIORO PSICOCOGNITIVO EN PACIENTES CON CARDIOPATÍA CONGÉNITA EN LISTA DE ESPERA PARA TRASPLANTE CARDIACO
- 8 - ENFERMEDAD RENAL CRÓNICA TRAS EL TRASPLANTE CARDIACO. EVOLUCIÓN A LARGO PLAZO
- 16 - RESULTADOS DEL EMPLEO DE ASISTENCIAS VENTRICULARES TEMPORALES PARA PACIENTES EN SHOCK CARDIOGÉNICO EN FUNCIÓN DEL DISPOSITIVO Y DEL MOMENTO EVOLUTIVO DEL IMPLANTE
- 8 - EVALUACIÓN PRECOZ DE LA RESISTENCIA DIURÉTICA: FACTORES PREDICTORES E IMPACTO EN LA EVOLUCIÓN DE PACIENTES CON INSUFICIENCIA CARDIACA AGUDA
