SEC 2021 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Héctor Bueno
Presidente del Comité Científico del Congreso
Comité ejecutivo
Comité de evaluadores
Listado de sesiones
Índice de autores
6028. Cardio-oncología: los senderos más complicados albergan las mejores recompensas
6028-15. FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria.
Introducción y objetivos: El trasplante de médula ósea (TMO) forma parte del tratamiento de las neoplasias hematológicas. El uso de fármacos quimioterápicos potencialmente cardiotóxicos puede aumentar el riesgo de desarrollo de insuficiencia cardiaca (IC). El objetivo de nuestro estudio fue describir las características de la población trasplantada que desarrolló IC y su implicación pronóstica.
Métodos: Se realizó un análisis ambiespectivo de todos los pacientes que recibieron TMO (autólogo y alogénico) en el servicio de hematología de nuestro centro entre enero de 2018 y enero de 2021. Se recogieron datos epidemiológicos, analíticos y ecocardiográficos según la práctica habitual en nuestro hospital.
Resultados: Se incluyeron 178 pacientes, de los cuales un 11,8% (n = 21) desarrolló IC. Los pacientes con IC eran mayores (56,9 vs 52,04, p = 0,195), sin encontrarse diferencias en relación al género. Respecto a las comorbilidades, aquellos pacientes con IC tenían mayor prevalencia de fibrilación auricular y neoplasias previas. El uso de antraciclinas y ciclofosfamida como parte del tratamiento quimioterápico se asoció con una mayor incidencia de IC (57,1 vs 76,2%, p = 0,094; 43,9 vs 81%, p = 0,001). Respecto a los datos analíticos, en los pacientes que desarrollaban IC se objetivó un empeoramiento de la función renal de forma estadísticamente significativa. También en estos pacientes se observó una mayor prevalencia en la caída de la función ventricular (diferencia > 10 puntos respecto a FEVI basal). Los pacientes con disfunción diastólica e insuficiencia mitral (IM) previa desarrollaron de forma más frecuente IC en el seguimiento (37,7 vs 66,7%, p = 0,012; 29,1 vs 42,9% p = 0,202) (fig.). Por último, se objetiva una mayor tasa de reingresos, así como una mayor mortalidad (22,9 vs 85,7%, p ≤ 0,001), en el grupo con IC.
|
Características clínicas |
|||
|
No ingresos por IC post |
Ingresos post IC |
p |
|
|
N = 157 (88,2%) |
N = 21 (11,8%) |
||
|
Características clínicas |
|||
|
Varón |
91 (58%) |
10 (47,6%) |
0,369 |
|
Mujer |
66 (42%) |
11 (52,4%) |
|
|
FA |
3 (1,9%) |
3 (14,3%) |
0,003 |
|
Neoplasia previa |
20 (12,7%) |
5 (23,8%) |
0,170 |
|
Quimioterapia |
149 (94,9%) |
21 (100%) |
0,290 |
|
Antraciclinas |
89 (57,1%) |
16 (76,2%) |
0,094 |
|
Ciclofosfamida |
69 (43,9%) |
17 (81%) |
0,001 |
|
Datos analíticos |
|||
|
FGE previo TMO |
95,9 (84; 106,9) |
92 (64,3; 115) |
0,645 |
|
FGE post-TMO |
94,4 (72,3; 109) |
57,2 (45,9; 106,5) |
0,016 |
|
Datos ecocardiográficos |
|||
|
FEVI previa TMO |
64,08 ± 5,63 |
61,64 ± 7,16 |
0,676 |
|
FEVI post-TMO |
65,74 ± 7,07 |
63,36 ± 13,96 |
0,432 |
|
FEVI previa TMO <50% |
2 (1,3%) |
2 (9,5%) |
0,017 |
|
Caída FEVI ≥ 10% |
9 (7,3%) |
3 (20%) |
0,097 |
|
Pronóstico |
|||
|
Ingreso post-TMO |
36 (22,9%) |
11 (52,4%) |
0,004 |
|
Exitus |
36 (22,9%) |
18 (85,7%) |
< 0,001 |
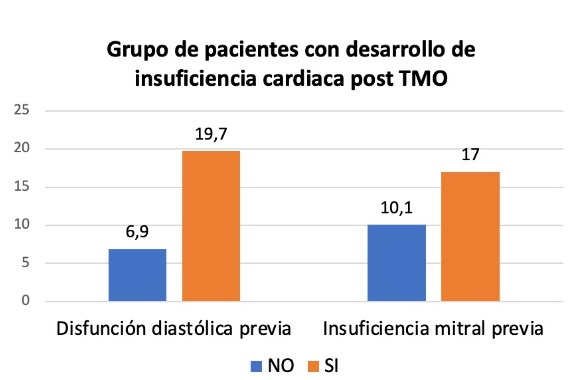
Pacientes con desarrollo de IC tras TMO.
Conclusiones: La aparición de IC tras el TMO es una complicación frecuente y que condiciona un peor pronóstico a su enfermedad de base. Debemos diseñar protocolos específicos para el seguimiento de estos pacientes, que ayuden a realizar un diagnóstico precoz y reducir el impacto de los fármacos cardiotóxicos sobre la patología cardiovascular.
Comunicaciones disponibles de "Cardio-oncología: los senderos más complicados albergan las mejores recompensas"
- 6028-1. MODERADORA
- Begoña Muñoz Giner, Valencia
- 6028-2. STRAIN DE VENTRÍCULO IZQUIERDO COMO MARCADOR PRECOZ DE NECESIDAD DE SEGUIMIENTO ECOCARDIOGRÁFICO EN PACIENTES CON CÁNCER DE MAMA: ESTUDIO EN VIDA REAL
- Ignacio Gallo Fernández, Fátima Esteban Martínez, Mónica Delgado Ortega, Ana Rodríguez Almodóvar, Martín Ruiz Ortiz, Josué López Baizán, Daniel Pastor Wulf, Jesús Rodríguez Nieto, Alberto Piserra López-Fernández de Heredia, Jorge Perea Armijo, Rafael González Manzanares, Cristina Pericet Rodríguez, Ana Fernández Ruiz, Manuel Pan Álvarez-Osorio y Dolores Mesa Rubio
Hospital Universitario Reina Sofía, Córdoba.
- 6028-3. ESTUDIO DE VALORACIÓN DE LA DISFUNCIÓN VENTRICULAR IZQUIERDA ASOCIADA AL USO DEL INHIBIDOR DE LA DIMERIZACIÓN DE HER2 PERTUZUMAB EN PACIENTES CON CÁNCER DE MAMA HER2 POSITIVO
- Irene Toribio-García1, Alejandro Olivares-Hernández2, Roberto Andrés Escala-Cornejo3, Julio Echarte-Morales1, Alba Martín-Centellas1, Javier Borrego-Rodríguez1, Itsaso Larrabide-Eguren1, Claudia Santos-García1, Clea González-Maniega1, Enrique Sánchez-Muñoz1, Rubén Bergel-García1, Javier Maíllo-Seco1, Carlos Galán-Fariña1, César Augusto Rodríguez-Sánchez2 y Felipe Fernández-Vázquez1
1Servicio de Cardiología, Complejo Asistencial Universitario de León. 2Servicio de Oncología Médica, Hospital Universitario de Salamanca. 3Sociedad de Lucha Contra el Cáncer del Ecuador, Guayaquil (Ecuador).
- 6028-4. CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- Beatriz Aguiar Bermúdez, Jesmar Alejandro Ramonis Quintero, Mario Galván Ruiz, Javier Bautista García, Miguel Fernández de Sanmamed Girón, Melissa Torres Ochando, Leslie González Pinedo, José Antonio Bonilla Fernández, Marcos Escobar González, Irina Suárez Pérez, David Rúa-Figueroa Erausquin, Verónica Quevedo Nelson, Antonio García Quintana, María Perera Álvarez y Eduardo José Caballero Dorta
Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria.
- 6028-5. VARIABILIDAD ENTRE CENTROS EN EL EMPLEO DE ANTICOAGULANTES DIRECTOS EN PACIENTES CON CÁNCER DE PULMÓN ACTIVO Y FIBRILACIÓN AURICULAR. DATOS DEL REGISTRO CANAC-FA
- Inara Alarcón de la Lastra Cubiles1, Alberto Piserra López-Fernández de Heredia2, María Inmaculada Fernández Valenzuela3, Magdalena Carrillo Bailén4, Arancha Díaz Expósito5, Alberto Moreno Vega6, Marinela Chaparro Muñoz3, Teresa García Manrique7, Javier Torres Llergo4, David Fernández Garay8, Alejandro Isidoro Pérez Cabeza5, Manuel Zalabardo9, José Javier Sánchez Fernández1, Julio Calvete Cadenas10 y Martín Ruiz Ortiz2, en representación de los Grupos de Trabajo de Fibrilación Auricular y Cardio-Onco-Hematología de la Sociedad Andaluza de Cardiología
1Servicio de Cardiología, Hospital Universitario Puerta del Mar, Cádiz. 2Servicio de Cardiología, Hospital Universitario Reina Sofía, Córdoba. 3Servicio de Cardiología, Hospital Universitario Virgen Macarena, Sevilla. 4Servicio de Cardiología, Complejo Hospitalario de Jaén. 5Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 6Servicio de Oncología Médica, Hospital Universitario Reina Sofía, Córdoba. 7Servicio de Oncología Médica, Hospital Universitario Virgen Macarena, Sevilla. 8Servicio de Oncología Médica, Complejo Hospitalario de Jaén. 9Servicio de Oncología Médica, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 10Servicio de Oncología Médica, Hospital Universitario Puerta del Mar, Cádiz.
- 6028-6. HEPARINAS DE BAJO PESO MOLECULAR EN PACIENTES ANTICOAGULADOS CON CÁNCER DE PULMÓN ACTIVO Y FIBRILACIÓN AURICULAR: FACTORES ASOCIADOS A SU PRESCRIPCIÓN. UN SUBANÁLISIS DEL REGISTRO CANAC-FA
- Magdalena Carrillo Bailén1, Alberto Piserra López-Fernández de Heredia2, Inmaculada Fernández Valenzuela3, Arancha Díaz Expósito4, Inara Alarcón de la Lastra Cubiles5, Alberto Moreno Vega6, Marinela Chaparro Muñoz3, Teresa García Manrique7, Javier Torres Llergo1, David Fernández Garay8, Alejandro Isidoro Pérez Cabeza4, Manuel Zalabardo9, José Javier Sánchez Fernández5, Julio Calvete Cadenas10 y Martín Ruiz Ortiz2, en representación de los Grupos de Trabajo de Fibrilación Auricular y Cardio-Onco-Hematología de la Sociedad Andaluza de Cardiología
1Servicio de Cardiología, Complejo Hospitalario de Jaén. 2Servicio de Cardiología, Hospital Universitario Reina Sofía, Córdoba. 3Servicio de Cardiología, Hospital Universitario Virgen Macarena, Sevilla. 4Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 5Servicio de Cardiología, Hospital Universitario Puerta del Mar, Cádiz. 6Servicio de Oncología Médica, Hospital Universitario Reina Sofía, Córdoba. 7Servicio de Oncología Médica, Hospital Universitario Virgen Macarena, Sevilla. 8Servicio de Oncología Médica, Complejo Hospitalario de Jaén. 9Servicio de Oncología Médica, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 10Servicio de Oncología Médica, Hospital Universitario Puerta del Mar, Cádiz.
- 6028-7. ANTICOAGULANTES DIRECTOS EN PACIENTES ANTICOAGULADOS CON CÁNCER DE PULMÓN ACTIVO Y FIBRILACIÓN AURICULAR: VARIABLES CLÍNICAS ASOCIADAS A SU USO. DATOS DEL REGISTRO CANAC-FA
- Alberto Piserra López-Fernández de Heredia1, Arancha Díaz Expósito2, Inmaculada Fernández Valenzuela3, Magdalena Carrillo Bailén4, Inara Alarcón de la Lastra Cubiles5, Alberto Moreno Vega6, Marinela Chaparro Muñoz3, Teresa García Manrique7, Javier Torres Llergo4, David Fernández Garay8, Alejandro Isidoro Pérez Cabeza9, Manuel Zalabardo2, José Javier Sánchez Fernández5, Julio Calvete Cadenas10 y Martín Ruiz Ortiz1, en representación de los Grupos de Trabajo de Fibrilación Auricular y Cardio-Onco-Hematología de la Sociedad Andaluza de Cardiología
1Servicio de Cardiología, Hospital Universitario Reina Sofía, Córdoba. 2Servicio de Oncología Médica, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 3Servicio de Cardiología, Hospital Universitario Virgen Macarena, Sevilla. 4Servicio de Cardiología, Complejo Hospitalario de Jaén. 5Servicio de Cardiología, Hospital Universitario Puerta del Mar, Cádiz. 6Servicio de Oncología Médica, Hospital Universitario Reina Sofía, Córdoba. 7Servicio de Oncología Médica, Hospital Universitario Virgen Macarena, Sevilla. 8Servicio de Oncología Médica, Complejo Hospitalario de Jaén. 9Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 10Servicio de Oncología Médica, Hospital Universitario Puerta del Mar, Cádiz.
- 6028-8. CÁNCER Y GESTACIÓN: ¿SABEMOS QUÉ HACER?
- Borja Rivero Santana1, Teresa López Fernández1, José Ignacio Sánchez Méndez1, Víctor Manuel Juárez Olmos1, Cristina Contreras Lorenzo1, Regina Dalmau González-Gallarza1, María Lucía Fernández Gassó, Silvia Valbuena López, Esther Pérez David, Francisco Javier Domínguez Melcón, Gabriela Guzmán Martínez, Roberto Flórez Gómez, Ana Alonso Ladreda, Esteban López de Sá y Areses y Pilar Zamora Auñón
Hospital Universitario La Paz, Madrid.
- 6028-9. IBRUTINIB Y RIESGO CV, ¿TIENE EL CARDIÓLOGO ALGO QUE DECIR?
- Víctor M. Juárez Olmos, Cristina Contreras Lorenzo, Borja Rivero Santana, Andrea Severo Sánchez, María Lucía Fernández Gassó, Silvia Valbuena López, Esther Pérez David, Miguel Ángel Canales Albendea, Patricia Baltasar Tello, Daniel Tébar Márquez, Isabel Dolores Poveda Pinedo, Emilio Arbas Redondo, Carlos Merino Argos, Esteban López de Sá y Areses y Teresa López Fernández
Hospital Universitario La Paz, Madrid.
- 6028-10. PERFIL DE BIOMARCADORES POSTRASPLANTE DE PROGENITORES HEMATOPOYÉTICAS COMO MARCADORES DE CARDIOTOXICIDAD PRECOZ, UNA EXPERIENCIA UNICÉNTRICA DE LA PRÁCTICA CLÍNICA REAL CON SEGUIMIENTO A CORTO PLAZO
- Soledad Murguía Salgado1, Federico Pagnussat2, Andrea Simeone1, Mariela Lujambio1, Mónica Delorenzi1, Federico Acquistapace3, Federico Ferrando-Castagnetto3, Gabriel Borelli2 y Raúl Gabús2
1Hospital Maciel, ASSE, Servicio de Cardiología, Montevideo (Uruguay). 2Servicio de Hematología, Hospital Maciel. ASSE-MSP, Montevideo (Uruguay). 3Centro Cardiovascular Universitario, Hospital de Clínicas, Facultad de Medicina, Montevideo (Uruguay).
- 6028-11. EVENTOS CARDIOVASCULARES RELACIONADOS CON IBRUTINIB Y SUS IMPLICACIONES PRONÓSTICAS, EXPERIENCIA EN NUESTRO CENTRO
- José María Gimeno Montes, Carmen Corral Fernández, Carmen García Corrales, Mª Eugenia Fuentes Cañamero, Luis Bravo García-Cuevas, Patricia Trinidad Márquez Lozano, María Yuste Domínguez, M. Victoria Millán Núñez y Miguel Sánchez Sánchez
Complejo Hospitalario Universitario de Badajoz.
- 6028-12. CARDIOTOXICIDAD POR IBRUTINIB, CARDIOLOGÍA AL RESCATE
- Cristina Contreras Lorenzo, Víctor M. Juárez Olmos, Borja Rivero Santana, Lucía Cobarro Gálvez, Andrea Severo Sánchez, Isabel Dolores Poveda Pinedo, Clara Ugueto Rodrigo, María Lucía Fernández Gassó, Francisco Javier Domínguez Melcón, Silvia Cayetana Valbuena López, Miguel Ángel Canales Albendea, Patricia Baltasar Tello, Esther Pérez David, Esteban López de Sá y Areses y Teresa López Fernández
Hospital Universitario La Paz, Madrid.
- 6028-13. RIESGO DE FIBRILACIÓN AURICULAR TRAS IBRUTINIB EN PACIENTES CON LLC
- Rubén Bergel García, Ágata Almela Gallego, Clea González Maniega, Enrique Sánchez Muñoz, Paula Menéndez Suárez, Julio Echarte Morales, Javier Borrego Rodríguez, Alba Martín Centellas, Carlos Galán Fariña, Javier Maillo Seco, Itsaso Larrabide Eguren, Claudia Santos García, Irene Toribio García, Silvia Prieto González y Felipe Fernández Vázquez
Servicio de Cardiología, Complejo Asistencial Universitario de León.
- 6028-14. ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- Miguel Fernández de Sanmamed Girón, Mario Galván Ruiz, Jesmar Alejandro Ramonis Quintero, Javier Bautista García, Beatriz Aguiar Bermúdez, Melissa Torres Ochando, Leslie González Pinedo, Manjot Singh, Pedro Peña Ortega, Haridian Mendoza Lemes, Marta López Pérez, María del Val Groba Marco, Antonio García Quintana, María Perera Álvarez y Eduardo José Caballero Dorta
Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria.
- 6028-15. FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- Javier Bautista García, Jesmar Alejandro Ramonis Quintero, Mario Galván Ruiz, Beatriz Aguiar Bermudez, Miguel Fernández de Sanmamed Girón, Melissa Torres Ochando, Leslie González Pinedo, Pedro Peña Ortega, Aridane Cárdenes León, Manjot Singh, David Rúa-Figueroa Erausquin, Pedro Martín Lorenzo, Antonio García Quintana, María Perera Álvarez y Eduardo José Caballero Dorta
Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria.
- 6028-16. PERFIL CLÍNICO DE LOS PACIENTES CON CÁNCER DE PULMÓN ACTIVO Y FIBRILACIÓN AURICULAR EN LAS CONSULTAS DE ONCOLOGÍA MÉDICA: DATOS DEL REGISTRO CANAC-FA, UN ESTUDIO OBSERVACIONAL, RETROSPECTIVO Y MULTICÉNTRICO
- Arancha Díaz Expósito1, Alberto Piserra López-Fernández de Heredia2, Inmaculada Fernández Valenzuela3, Magdalena Carrillo Bailén4, Inara Alarcón de la Lastra Cubiles5, Alberto Moreno Vega6, Marinela Chaparro Muñoz3, Teresa García Manrique7, Javier Torres Llergo4, David Fernández Garay8, Alejandro Isidoro Pérez Cabeza1, Manuel Zalabardo9, José Javier Sánchez Fernández5, Julio Calvete Cadenas10 y Martín Ruiz Ortiz2, en representación de los Grupos de Trabajo de Fibrilación Auricular y Cardio-Onco-Hematología de la Sociedad Andaluza de Cardiología
1Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 2Servicio de Cardiología, Hospital Universitario Reina Sofía, Córdoba. 3Servicio de Cardiología, Hospital Universitario Virgen Macarena, Sevilla. 4Servicio de Cardiología, Complejo Hospitalario de Jaén. 5Servicio de Cardiología, Hospital Universitario Puerta del Mar, Cádiz. 6Servicio de Oncología Médica, Hospital Universitario Reina Sofía, Córdoba. 7Servicio de Oncología Médica, Hospital Universitario Virgen Macarena, Sevilla. 8Servicio de Oncología Médica, Complejo Hospitalario de Jaén. 9Servicio de Oncología Médica, Hospital Clínico Universitario Virgen de la Victoria, Málaga. 10Servicio de Oncología Médica, Hospital Universitario Puerta del Mar, Cádiz.
Más comunicaciones de los autores
-
Aguiar Bermúdez, Beatriz
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
-
Bautista García, Javier
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
-
Caballero Dorta, Eduardo José
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 6046-9 - TERAPIA DE RESINCRONIZACIÓN CARDIACA Y SUPERVIVENCIA A LARGO PLAZO (17 AÑOS)
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6024-6 - TERAPIA DE RESINCRONIZACIÓN CARDIACA Y MUERTE. ESTUDIO RETROSPECTIVO EN UNA COHORTE A LARGO PLAZO
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
-
Cárdenes León, Aridane
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
-
Fernández de Sanmamed Girón, Miguel
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
-
Galván Ruiz, Mario
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
-
García Quintana, Antonio
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
-
González Pinedo, Leslie
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
-
Martín Lorenzo, Pedro
- 5009-6 - RESPUESTA ELECTROCARDIOGRÁFICA AL IMPLANTE DE 6 DISPOSITIVOS TAVI DIFERENTES: RESULTADOS DEL ESTUDIO MATCHBALL 2
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
-
Peña Ortega, Pedro
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
-
Perera Álvarez, María
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
-
Ramonis Quintero, Jesmar Alejandro
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
-
Rúa-Figueroa Erausquin, David
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
-
Singh, Manjot
- 4011-7 - EXPERIENCIA DE USO DE IPCSK9 EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR EN VIDA REAL
- 6033-12 - EXPERIENCIA DE USO DEL SACUBITRILO-VALSARTÁN EN PACIENTES CON INSUFICIENCIA CARDIACA Y TERAPIA RENAL SUSTITUTIVA
- 6039-4 - VALOR PRONÓSTICO DE LOS BIOMARCADORES CARDIACOS EN LOS PACIENTES CON AMILOIDOSIS CARDIACA
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
- 5026-6 - ANÁLISIS DE SUPERVIVENCIA EN PACIENTES DIAGNOSTICADOS DE AMILOIDOSIS CARDIACA
- 5016-8 - DEA MÓVILES O FIJOS PARA CUBRIR UNA POBLACIÓN GEOGRÁFICAMENTE DISPERSA: ANÁLISIS DEL PROYECTO «GIRONA TERRITORI CARDIOPROTEGIT»
-
Torres Ochando, Melissa
- 6028-14 - ¿ES NECESARIO EL SEGUIMIENTO CARDIOLÓGICO EN LOS TRASPLANTADOS DE MÉDULA ÓSEA?
- 6028-4 - CARDIOTOXICIDAD EN EL TRASPLANTE DE MÉDULA ÓSEA: ¿EXISTEN DIFERENCIAS ENTRE EL AUTÓLOGO Y EL ALOGÉNICO?
- 6028-15 - FACTORES PREDICTORES DE DESARROLLO DE INSUFICIENCIA CARDIACA TRAS EL TRASPLANTE DE MÉDULA ÓSEA
