SEC 2020 - El e-Congreso de la Salud Cardiovascular
Introducción
Dr. Héctor Bueno
Presidente del Comité Científico del Congreso
Comité ejecutivo
Comité de evaluadores
Listado de sesiones
Índice de autores
5016. Cardiopatías familiares, muerte súbita y genética cardiovascular
5016-7. LA DISFUNCIÓN DE KIR2,1 SUBYACE A LOS DEFECTOS ELECTROMECÁNICOS QUE CONDUCEN A ARRITMIAS EN UN MODELO DE RATÓN DEL SÍNDROME DE ANDERSEN-TAWIL TIPO 1
Centro Nacional de Investigaciones Cardiovasculares (CNIC), Madrid.
Introducción y objetivos: El síndrome de Andersen-Tawil tipo 1 (ATS1), causado por el tráfico de mutaciones deficientes en KCNJ2, se asocia con arritmias cardiacas fatales. Sin embargo, los mecanismos subyacentes son poco conocidos. Por ello, el presente trabajo se realizó con el objetivo de probar si la expresión cardiaca específica de Kir2.1 deficientes en el tráfico proteico en ratones in vivo, recapitula el fenotipo eléctrico cardiaco de ATS1 e investiga los mecanismos moleculares subyacentes.
Métodos: Generamos un nuevo modelo murino de ATS1 mediante inyección única i.v. de virus adenoasociados (AAV) específica cardiaca con Kir2.1Δ314-315, que recapituló el fenotipo ATS1 ECG sin modificar la función ventricular.
Resultados: Los ratones AAV-Kir2.1Δ314-315 fueron significativamente más sensibles al bloqueo del canal de sodio (flecainida i.v. 20 mg/Kg) que el control, aumentando los intervalos PR y QRS durante un período de 300 segundos. En la estimulación intracardiaca, los ratones Kir2.1Δ314-315 tuvieron una mayor vulnerabilidad a la fibrilación cardiaca. Experimentos de patch-clamp en cardiomiocitos ventriculares aislados de ratones Kir2.1Δ314-315 demostraron una reducción significativa de las corrientes iónicas IK1 e INa, un potencial de membrana en reposo despolarizado y una duración del potencial de acción prolongada. La inmunolocalización en ratones control reveló dos bandas de tinción Kir2.1, una colocalizante con NaV1.5 y AP1 cerca del disco Z; y la otra cerca de la zona H. Los cardiomiocitos Kir2.1Δ314-315 mostraron alteración del canalosoma Kir2.1-Nav1.5 en el sarcolema, lo que indica el tráfico disfuncional de ambos canales. Además, Kir2.1 se localizó erróneamente y la dinámica transitoria del calcio se alteró, lo que resulta en eventos anormales de liberación espontánea de calcio y revela un defecto de acoplamiento excitación-contracción.
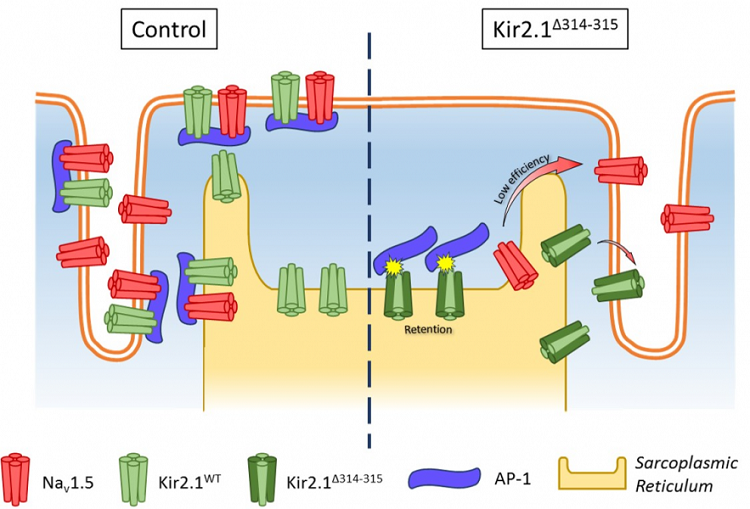
Modelo sugerido para el mecanismo subyacente a las alteraciones funcionales y moleculares del síndrome de Andersen-Tawil tipo 1 (ATS1).
Conclusiones: La transducción específica cardiaca de Kir2.1Δ314-315 mediante AAV en ratones recapitula el fenotipo ATS1 al alterar la localización y la función de Kir2.1, así como el canalosoma Kir2.1-NaV1.5, con importantes implicaciones en los mecanismos de arritmias en ATS1.
Comunicaciones disponibles de "Cardiopatías familiares, muerte súbita y genética cardiovascular"
- 5016-2. CRIBADO ACTIVO Y SECUENCIAL DE CASOS ÍNDICES DE HIPERCOLESTEROLEMIA FAMILIAR A PARTIR DE DATOS ANALÍTICOS CENTRALIZADOS
- Fernando Sabatel Pérez1, Joaquín Sánchez-Prieto Castillo1, Helena Contreras Mármol1, Víctor Manuel Becerra Muñoz2, Pedro Mata López3 y Luis Rodríguez Padial1
1Complejo Hospitalario de Toledo, SESCAM, Toledo. 2Hospital Clínico Universitario Virgen de la Victoria, Málaga. 3Fundación Hipercolesterolemia Familiar, Madrid.
- 5016-3. SUPERIORIDAD DE LOS CRITERIOS INMUNOHISTOQUÍMICOS SOBRE LOS CRITERIOS DE DALLAS EN EL DIAGNÓSTICO DE MIOCARDITIS Y MIOCARDIOPATÍA INFLAMATORIA
- Fernando Domínguez Rodríguez1, Rafael José Cobas Paz2, Juan Francisco Oteo Domínguez1, Francisco Hernández Pérez1, Manuel Gómez Bueno1, Clara Salas Antón1, Marta Cobo Marcos1, Esther González López1, Luis Enrique Escobar López1, Silvia Vilches Soria1, Cristina Daniela Mitroi1, Pablo García Pavía1 y Javier Segovia Cubero1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid). 2Complexo Hospitalario Universitario de Vigo-Xeral-Cíes, Vigo (Pontevedra).
- 5016-4. EVENTOS EMBÓLICOS EN PACIENTES CON AMILOIDOSIS CARDIACA POR TRANSTIRETINA SIN FIBRILACIÓN AURICULAR
- Silvia Vilches Soria1, Esther González López1, Fernando Domínguez Rodríguez1, Luis Enrique Escobar López1, Adrián Rivas Pérez1, Aitor Hernández1, Stefano Perlini2, Claudio Rapezzi3, Mathew Maurer4, Julián Gillmore5 y Pablo García Pavía1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid). 2Universidad de Pavía (Italia). 3Universidad de Bolonia (Italia). 4Hospital Universitario de Columbia, Nueva York. 5Centro Nacional de Amiloidosis, Londres (Reino Unido).
- 5016-5. PERFIL CLÍNICO Y PRONÓSTICO DE LA MIOCARDITIS Y MIOCARDIOPATÍA INFLAMATORIA CONFIRMADA POR BIOPSIA ENDOMIOCÁRDICA
- Fernando Domínguez Rodríguez1, Rafael José Cobas Paz2, Juan Francisco Oteo Domínguez1, Francisco José Hernández Pérez1, Manuel Gómez Bueno1, Clara Salas Antón1, Marta Cobo Marcos1, Esther González López1, Luis Enrique Escobar López1, Silvia Vilches Soria1, Cristina Daniela Mitroi1, Pablo García Pavía1 y Javier Segovia Cubero1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid). 2Complexo Hospitalario Universitario de Vigo-Xeral-Cíes, Vigo (Pontevedra).
- 5016-6. ESTUDIO DE LAS ALTERACIONES GENÉTICAS EN PACIENTES CON HIPERCOLESTEROLEMIA FAMILIAR DEL ÁREA SANITARIA DE UN HOSPITAL DE TERCER NIVEL DETECTADOS MEDIANTE UNA NUEVA ESTRATEGIA DE CRIBADO SISTEMÁTICO PARTIENDO DE ANALÍTICA CENTRALIZADA PREEXISTENTE
- Joaquín Sánchez-Prieto Castillo, Fernando Sabatel Pérez, Helena Contreras Mármol, Carlos de Cabo Porras, Alejandro Gadella Fernández y Luis Rodríguez Padial
Complejo Hospitalario de Toledo.
- 5016-7. LA DISFUNCIÓN DE KIR2,1 SUBYACE A LOS DEFECTOS ELECTROMECÁNICOS QUE CONDUCEN A ARRITMIAS EN UN MODELO DE RATÓN DEL SÍNDROME DE ANDERSEN-TAWIL TIPO 1
- Álvaro Macías Martínez, Andrés González-Guerra, Ana Isabel Moreno Manuel, Francisco Miguel Cruz Uréndez, Francisco José Bermúdez Jiménez, Lilian Karina Gutiérrez-Espinosa de los Monteros, María Linarejos Vera-Pedrosa, Vicente Andrés, Juan A. Bernal y José Jalife
Centro Nacional de Investigaciones Cardiovasculares (CNIC), Madrid.
- 5016-8. PAPEL DEL ENTRECRUZAMIENTO DEL COLÁGENO EN LA AFECTACIÓN MIOCÁRDICA PRIMARIA EN EL SÍNDROME DE MARFAN: ESTUDIO DE BIOMARCADORES
- Eusebio García-Izquierdo Jaén1, Susana Mingo Santos1, Xabier Cia Mendioroz1, Vanessa Moñivas Palomero1, Carlos Esteban Martín López1, Sara Navarro Rico1, Silvia Rosado García2, María Gil Ligero2, Antonio J. Sánchez López2, Miguel A. Cavero Gibanel1, Juan Miguel Redondo3, Javier Segovia Cubero1 y Alberto Forteza Gil1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid). 2Instituto de Investigación Sanitaria Puerta de Hierro-Segovia de Arana. 3Centro Nacional de Investigaciones Cardiovasculares (CNIC), Madrid.
- 5016-9. MIOCARDIOPATÍA ARRITMOGÉNICA CON AFECTACIÓN PREDOMINANTE DE VENTRÍCULO IZQUIERDO. CARACTERÍSTICAS CLÍNICAS Y PRONÓSTICO
- José Miguel Martín Torres1, Eloísa Feliu Rey2, Amaya García-Fernández1, Laura García-Cano1, Rafal Mosciki3, Luna Carrillo Alemán4, Juan Gabriel Martínez Martínez1 y Juan Miguel Ruiz Nodar1
1Servicio de Cardiología, Hospital General Universitario de Alicante. 2Unidad de Resonancia Magnética, INSCANNER, Alicante. 3Servicio de Cardiología, Hospital General de Elda (Alicante). 4Servicio de Cardiología, Hospital de Torrevieja (Alicante).
- 5016-10. UTILIDAD DEL ESTUDIO GENÉTICO EN LA MUERTE SÚBITA CON HALLAZGOS HISTOPATOLÓGICOS INESPECÍFICOS EN LA AUTOPSIA
- Mercedes Iglesias1, Tomás Ripoll Vera1, Jorge Álvarez Rubio1, Consuelo Pérez Luengo2, Damián Heine Suñer3, Bernardino Barceló Martín3, Susana Moyano Corvillo4, Concepción Dasi Martínez4, Juan Carlos Canós Villena4 y Juan Carlos Borondo Alcázar4
1Hospital Universitario Son Llàtzer, Palma de Mallorca (Illes Balears). 2Instituto de Medicina Legal de las Islas Baleares, Palma de Mallorca (Illes Balears). 3Hospital Son Espases, Palma de Mallorca (Illes Balears). 4Instituto Nacional de Toxicología, Barcelona.
- 5016-11. EVENTOS EMBÓLICOS EN PACIENTES CON AMILOIDOSIS CARDIACA POR TRANSTIRETINA CON FIBRILACIÓN AURICULAR
- Silvia Vilches Soria1, Esther González López1, Fernando Domínguez Rodríguez1, Luis Enrique Escobar López1, Adrián Rivas Pérez1, Aitor Hernández1, Stefano Perlini2, Claudio Rapezzi3, Mathew Maurer4, Julian Gillmore5 y Pablo García Pavía1
1Hospital Universitario Puerta de Hierro, Majadahonda (Madrid). 2Universidad de Pavía (Italia). 3Universidad de Bolonia (Italia). 4Hospital Universitario de Columbia, Nueva York. 5Centro Nacional de Amiloidosis, Londres (Reino Unido).
- 5016-12. ANÁLISIS DE LAS DIFERENCIAS CLÍNICAS Y DIAGNÓSTICAS ENTRE LOS PACIENTES CON PATOLOGÍA AÓRTICA FAMILIAR SINDRÓMICA Y NO SINDRÓMICA
- Martín Negreira Caamaño1, Jesús Piqueras Flores2, Jorge Martínez del Río1, Manuel Muñoz García1, Daniel Águila Gordo1, Cristina Mateo Gómez1, María Inmaculada Vivo Ortega2 y María Arántzazu González Marín3
1Servicio de Cardiología. 2Unidad de Cardiopatías Familiares, Servicio de Cardiología. 3Servicio de Pediatría, Hospital General Universitario de Ciudad Real.
- 5016-13. IMPLICACIÓN DE MUTACIONES EN AKAP9 Y KCNH2 EN LA EXPRESIÓN CLÍNICA DEL SÍNDROME DE QT LARGO TIPO1
- Eduardo Arana-Rueda1, Carmen María González de la Portilla Concha1, Juan Acosta Martínez1, Manuel Frutos López1, María Luisa Peña Peña2, Marta Navarro Arenas3, Alonso Pedrote Martínez4 y Antonio Castellano5
1Unidad de Arritmias, Servicio de Cardiología, Hospital Universitario Virgen del Rocío, Sevilla. 2Unidad de Cardiopatía familiares, Hospital Universitario Virgen del Rocío, Sevilla. 3Hospital Universitario Nuestra Señora de la Merced, Osuna (Sevilla). 4Unidad de Arritmias, Servicio de Cardiología, Hospital Universitario Virgen del Rocío, Sevilla. 5Instituto de Investigación Biomédica de Sevilla.
- 5016-14. APLICACIÓN DEL NUEVO SCORE DE RIESGO DE MUERTE SÚBITA DE SIEIRA EN UNA POBLACIÓN CON SÍNDROME DE BRUGADA
- Lidia María Carrillo Mora, María Jesús Fernández Gil, Francisco Javier Lacunza Ruiz, Pablo Peñafiel Verdú, Carmen Muñoz Esparza, Ignacio Gil Ortega, David López Cuenca, Eva Cabrera Romero, María Sabater Molina y Juan Ramón Gimeno Blanes
Hospital Clínico Universitario Virgen de la Arrixaca, El Palmar (Murcia).
- 5016-15. PERFIL DE EXPRESIÓN DE MICRORNAS ASOCIADOS AL FENOTIPO EN PACIENTES DE SÍNDROME DE BRUGADA Y EN PORTADORES DE MUTACIÓN EN EL GEN SCN5A
- María Cebro Márquez1, Ricardo Lage Fernández2, María Brión Martínez3, Eva Ramos Luis4, Juan Ramón Gimeno Blanes5, José Ramón González Juanatey6, Isabel Moscoso Galán2 y Moisés Rodríguez Mañero6
1Centro Singular de Investigación en Medicina Molecular y Enfermedades Crónicas (CIMUS), Santiago de Compostela (A Coruña). 2Centro Singular de Investigación en Medicina Molecular y Enfermedades Crónicas (CIMUS), Santiago de Compostela (A Coruña), CIBERCV. 3Fundación Pública Galega de Medicina Xenómica, Santiago de Compostela (A Coruña), CIBERCV. 4Fundación Pública Galega de Medicina Xenómica, Santiago de Compostela (A Coruña). 5Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, CIBERCV. 6Complexo Hospitalario Universitario de Santiago de Compostela (A Coruña), CIBERCV.
- 5016-16. GEN FLNC EN LA MIOCARDIOPATÍA HIPERTRÓFICA: UN ESFUERZO PARA LOGRAR UNA CLASIFICACIÓN MÁS PRECISA DE LAS VARIANTES
- Elías Cuesta Llavona, Rebeca Lorca Gutiérrez, Beatriz Díaz Molina, José Luis Lambert Rodríguez, Sara Iglesias Álvarez, Belén Alonso González, José Julián Rodríguez Reguero, Eliecer Coto García y Juan Gómez de Oña
Hospital Universitario Central de Asturias, Oviedo (Asturias).
Más comunicaciones de los autores
- Andrés, Vicente
-
Bermúdez-Jiménez, Francisco José
- 5010-5 - ANÁLISIS DE LAS CARACTERÍSTICAS DIFERENCIALES MEDIANTE TÉCNICAS DE DEFORMACIÓN MIOCÁRDICA ENTRE LA MIOCARDIOPATÍA NO COMPACTADA Y LA MIOCARDIOPATÍA DILATADA NO ISQUÉMICA
- 5015-6 - AUSENCIA DE PROLONGACIÓN CLÍNICAMENTE RELEVANTE DEL INTERVALO QT EN PACIENTES ESTABLES CON COVID19 TRATADOS CON HIDROXICLOROQUINA, AZITROMICINA Y/O INHIBIDORES DE LA PROTEASA
- 5016-7 - LA DISFUNCIÓN DE KIR2,1 SUBYACE A LOS DEFECTOS ELECTROMECÁNICOS QUE CONDUCEN A ARRITMIAS EN UN MODELO DE RATÓN DEL SÍNDROME DE ANDERSEN-TAWIL TIPO 1
- Bernal, Juan A.
- Cruz Uréndez, Francisco Miguel
- González-Guerra, Andrés
- Gutiérrez-Espinosa de los Monteros, Lilian Karina
- Jalife, José
- Linarejos Vera-Pedrosa, María
- Macías Martínez, Álvaro
- Moreno Manuel, Ana Isabel
